Science celebra il centenario della cristallografia
Lo scorso venti gennaio l’Assemblea Generale delle Nazioni Unite ha inaugurato al palazzo dell’Unesco di Parigi l’Anno Internazionale della Cristallografia (IYCr2014).
Si tratta di una serie di iniziative volte a celebrare non solo il centenario della diffrazione a raggi X, che ha trasformato la nostra comprensione della struttura e del comportamento della “materia”, ma anche il quattrocentesimo anniversario dell’osservazione di Keplero della struttura simmetrica dei cristalli di ghiaccio (risalente al 1611), che diede il via ad una serie di studi sul ruolo della simmetria nella materia.
Le strutture cristalline degli zaffiri. (Credit: www.iycr2014.org).
Lo scopo è duplice: da un lato sensibilizzare l’opinione pubblica sulla cristallografia a raggi X, una scienza che permette di studiare qualunque tipo di materiale, artificiale e naturale (molecole dei viventi incluse), rivoluzionando il concetto stesso di sistema biologico. Dall’altro, far conoscere il funzionamento di tecnologie all’avanguardia, come il progetto SESAME (Luce di Sincrotone per Scienze Sperimentali e Applicate in Medio Oriente) sostenuto dall’UNESCO. In Italia l’anno sarà celebrato attraverso un programma di eventi patrocinati dal Consiglio Nazionale delle Ricerche (CNR) e organizzati dall’Associazione italiana di Cristallografia (AIC) in collaborazione con università e associazioni. Lo speciale che Science dedica a questo ambito di studi, e che qui presentiamo, si inserisce nel quadro di questo ampio progetto divulgativo.
Sappiamo che tutti i materiali devono le loro proprietà alla loro struttura, cioè al modo in cui gli atomi si dispongono nello spazio tridimensionale. Così, ad esempio, il diamante è molto duro, mentre la grafite è morbida. Questa caratteristica non ha nulla a che vedere con gli elementi di cui sono composti: sono entrambi fatti di carbonio. La differenza è dovuta al fatto che gli atomi di carbonio nel diamante sono tenuti insieme con una struttura molto rigida, mentre quelli nella grafite si dispongono come fogli che possono scivolare l’uno sull’altro.
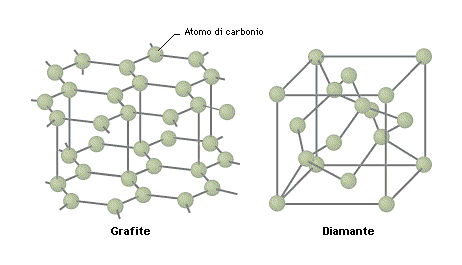
(Credit: wikipedia.org).
I materiali artificiali. Leggiamo su Science che risale al 1912 l’articolo di Max von Laue sui meccanismi di diffrazione dei raggi X attraverso un cristallo. L’esperimento di Max Von Laue è tanto semplice quanto rivoluzionario. Insieme ai suoi collaboratori illuminò con un fascio di raggi X un cristallo di blenda, un minerale costituito da solfuro di zinco, ottenendo una serie di macchie scure su una lastra fotografica. Il risultato? Il cristallo deviava i raggi X in fasci secondo direzioni determinate. La scoperta della cristallografia a raggi X, per la quale von Laue è stato insignito del Nobel nel 1914, ha aperto una finestra sulla struttura atomica dei cristalli. Oggi, il Cambridge Structural Database contiene più di 600.000 strutture di molecole organiche e organometalliche, molte delle quali sono state ottenute proprio grazie alla cristallografia a raggi X, mentre la Protein Data Bank ne contiene circa 100.000.
Materiali artificiali da un lato e proteine dal’altro: gli studi su Science procedono secondo queste due direttrici. J. A. K. Howard e M. R. Probert iniziano ricordando l’importanza di questi approcci nel settore non biologico. Si parla dunque di cristalli di molecole artificiali (Cutting-Edge Techniques Used for the Structural Investigation of Single Crystals), e i più recenti risultati confermano la possibilità di lavorare su campioni molto piccoli, fragili e instabili, senza comprometterne le caratteristiche salienti. Anche a basse temperature e a pressioni elevate.

Nell’immagine, da sinistra, si vedono i modelli strutturali della vitamina B12, una proteina GPCR e un ribosoma (credit: wikipedia).
Le biomolecole. Ma è sul secondo tema, nello studio delle proteine e delle biomolecole in generale, che i risultati e le applicazioni sono davvero innovativi. Qui pionieristico fu il lavoro di Dorothy Hodgkin che nel 1945 scoprì la struttura della prima molecola complessa, la penicillina, proprio grazie ai raggi X. Nel 1952 Rosalind Franklin userà la stessa tecnica per scoprire la struttura elicoidale del DNA). E. F. Garman ripercorre a questo proposito la storia della biochimica strutturale, dalla scoperta dei rapporti di diffrazione dei raggi X che bombardano i cristalli di pepsina, alla recente caratterizzazione dell’intero ribosoma e dei recettori accoppiati alle proteine G (o GPCR) in diversi stati di conformazione (Developments in X-ray Crystallographic tructure Determination of Biological Macromolecules).
E non c’è bisogno di ricordare l’importanza di questo settore: una tecnica per cristallizzare biomolecole fragili senza interrompere sta aiutando ricercatori a studiare le strutture di alcuni dei più importanti ma sfuggenti proteine del corpo, quelle che escono attraverso la membrana cellulare. Se si considera che per mappare la struttura atomica delle proteine bisogna “convincere” le molecole ad allinearsi perfettamente – un po’ come mettere in fila un plotone di soldati, precisa Garman – per le proteine di membrana la faccenda non è così semplice, e i problemi da affrontare sono ancora numerosi. Da questo punto di vista, l’approccio della Fase Cubica Lipidica (LCP) sembra dare i risultati migliori, accanto all’uso delle radiazioni di sincrotrone e alla raccolta dei dati attraverso la spettroscopia.
R. J. D. Miller (Femtosecond Crystallography with Ultrabright Electrons and X-rays: Capturing Chemistry in Action), proprio grazie al successo delle ricerche sulle struttura cristallografiche statiche, ci presenta gli ultimi sforzi degli scienziati per mappare in tempo reale i movimenti atomici nei cristalli. Qui la tecnica sfrutta le capacità delle sorgenti di elettroni di “illuminare” i campioni in modo da rendere osservabili le transizioni di fase foto indotte (e le corrispondenti reazioni organiche).
Le ricerche in atto mostrano i progressi e i risultati raggiunti, come l’estremo bisogno che abbiamo di finanziare queste ricerche. Nel 2013 la cristallografia ha fornito la prima immagine dettagliata della struttura delle proteine invase dal virus dell’HIV. Oggi abbiamo raggi X sempre migliori, calcolatori molto potenti per progettare nuovi farmaci e nuovi materiali per il futuro. Purtroppo, Protein Structure – uno dei principali programmi di ricerca sponsorizzati dal National Institutes of Health – dovrebbe chiudere i battenti nel 2015. Un duro colpo, non solo per la biologia strutturale.

